Agência de Notícias Xinhua, Tianjin (Repórteres Zhang Jianxin, Li Yating) A equipe de Liu Shulin, pesquisador da Escola de Química da Universidade de Nankai, na China, desenvolveu recentemente com sucesso uma nova via de amplo espectro para o vírus anti-influenza. Esta estratégia perturba fundamentalmente a vantagem evolutiva do vírus ao degradar sincronicamente vários componentes-chave no centro da replicação viral, estabelecendo uma base sólida para o desenvolvimento da próxima geração de medicamentos anti-influenza potentes, duráveis e de amplo espectro. Resultados relevantes de pesquisas foram publicados recentemente na revista acadêmica internacional "Journal of the American Chemical Society".
De acordo com a equipe de pesquisa, os vírus influenza A podem facilmente escapar das respostas imunológicas do hospedeiro e dos medicamentos existentes devido à sua alta taxa de mutação. Os atuais medicamentos antivirais usados clinicamente geralmente só podem atingir um único alvo do vírus, o que torna mais fácil para o vírus desenvolver resistência aos medicamentos por meio de mutação, resultando em um efeito do medicamento bastante reduzido e eficácia limitada de amplo espectro. Novas estratégias de tratamento são urgentemente necessárias em todo o mundo.
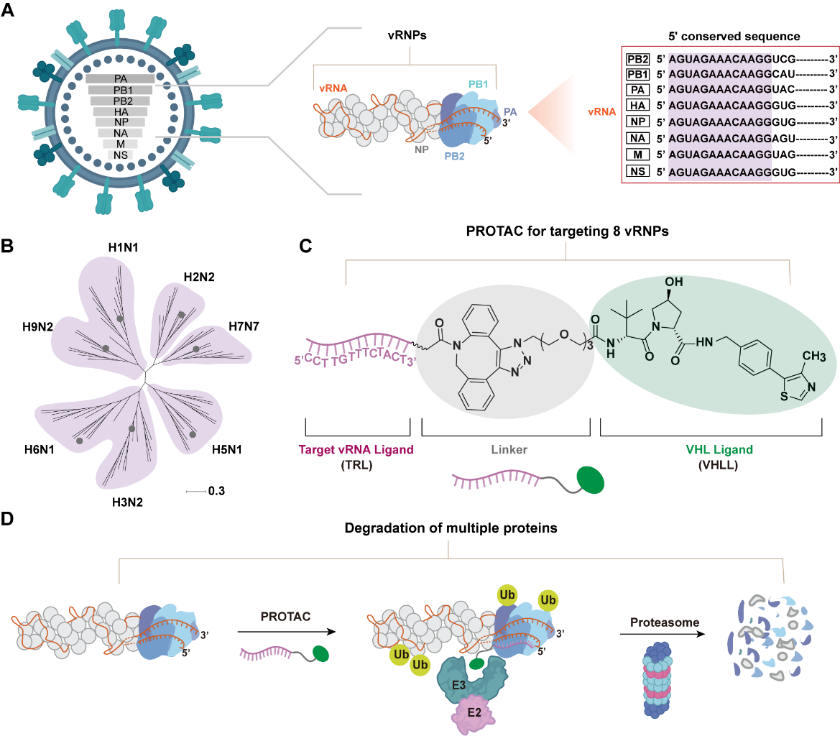
Diagrama esquemático da degradação mediada por PROTAC de proteínas multivirais. A Agência de Notícias Xinhua informou que Liu Shulin apresentou que a equipe desenvolveu uma estratégia antivírus chamada "Multiplex PROTAC". Seu mecanismo central reside no uso inteligente de uma região 5' não traduzida altamente conservada no RNA viral de direcionamento, que é considerado o "código universal". Com base nisso, pesquisadores de sua equipe desenvolveram uma molécula PROTAC multifuncional. Uma extremidade da molécula pode reconhecer e ligar com precisão o “código universal” do vírus, e a outra extremidade é responsável pelo recrutamento do proteassoma, o sistema inerente de degradação de proteínas nas células humanas. Este design faz com que a molécula atue como um “cavalo de Tróia”. Depois de entrar em uma célula infectada, ele pode se conectar ao complexo de ribonucleoproteína viral, ao núcleo da replicação viral e ao "triturador" da célula ao mesmo tempo, marcando assim a proteína central do vírus como uma marca de "destruição" e, em seguida, guiando a maquinaria celular para degradar completamente essas partes-chave para a replicação viral, destruindo a capacidade de replicação do vírus a partir da fonte.
Os resultados experimentais da equipe mostram que a estratégia PROTAC múltipla apresenta excelente desempenho antiviral. Não só pode inibir eficazmente a replicação viral de uma forma dependente da concentração, como também o seu efeito inibitório pode durar mais de 48 horas. Sua persistência e eficácia são significativamente melhores que os medicamentos de controle de alvo único. O que é particularmente crítico é que esta estratégia constrói com sucesso uma barreira de alta resistência genética, degradando sincronicamente múltiplas proteínas virais. Isto significa que se o vírus quiser escapar, deve ter mutações de escape eficazes em vários alvos-chave ao mesmo tempo. Isto constitui um obstáculo intransponível para o vírus na evolução natural e reduz o risco de resistência aos medicamentos. Além disso, esta estratégia mostrou atividade de amplo espectro contra múltiplas cepas de influenza, destacando seu potencial como medicamento anti-influenza de amplo espectro.
Os revisores comentaram que a versatilidade desta estratégia também proporciona um novo caminho técnico e espaço de imaginação para lidar com outros vírus em rápida mutação no futuro.