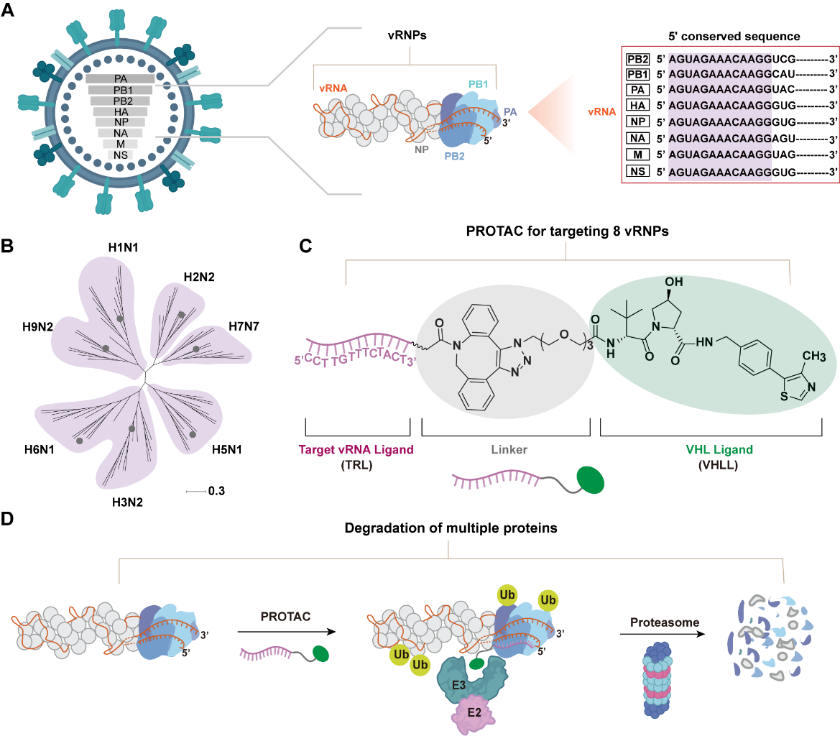
Nachrichtenagentur Xinhua, Tianjin (Reporter Zhang Jianxin, Li Yating) Das Team von Liu Shulin, einem Forscher an der Fakultät für Chemie der Nankai-Universität in China, hat kürzlich erfolgreich einen neuen Breitband-Anti-Influenza-Virusweg entwickelt. Diese Strategie zerstört den evolutionären Vorteil des Virus grundlegend, indem sie mehrere Schlüsselkomponenten im Kern der Virusreplikation gleichzeitig abbaut und so eine solide Grundlage für die Entwicklung der nächsten Generation wirksamer, langlebiger und breit wirkender Anti-Influenza-Medikamente legt. Relevante Forschungsergebnisse wurden kürzlich in der internationalen Fachzeitschrift „Journal of the American Chemical Society“ veröffentlicht.
Laut dem Forschungsteam können Influenza-A-Viren aufgrund ihrer hohen Mutationsrate leicht den Immunantworten des Wirts und vorhandenen Medikamenten entgehen. Gegenwärtig klinisch eingesetzte antivirale Medikamente können in der Regel nur auf ein einziges Ziel des Virus abzielen, was es dem Virus leicht macht, durch Mutation eine Arzneimittelresistenz zu entwickeln, was zu einer stark verringerten Arzneimittelwirkung und einer begrenzten Breitbandwirksamkeit führt. Neue Behandlungsstrategien werden weltweit dringend benötigt.
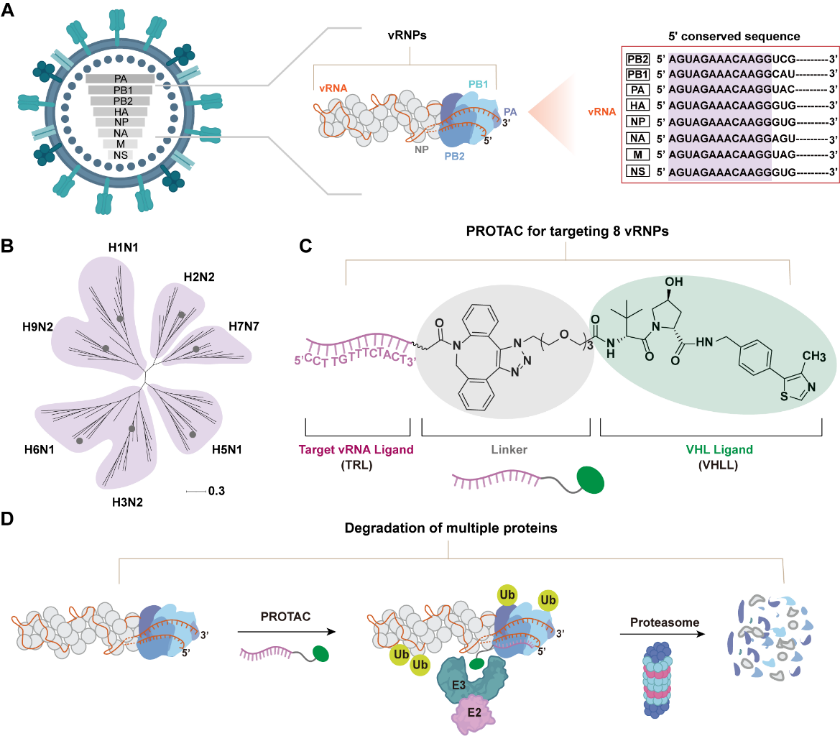
Schematische Darstellung des PROTAC-vermittelten Abbaus multiviraler Proteine. Die Nachrichtenagentur Xinhua berichtete, dass Liu Shulin bekannt gab, dass das Team eine Antivirenstrategie namens „Multiplex PROTAC“ entwickelt habe. Sein Kernmechanismus liegt in der geschickten Nutzung einer hochkonservierten 5'-untranslatierten Region in der zielgerichteten viralen RNA, die als „universeller Code“ gilt. Darauf aufbauend entwarfen Forscher ihres Teams ein multifunktionales PROTAC-Molekül. Ein Ende des Moleküls kann den „universellen Code“ des Virus genau erkennen und binden, und das andere Ende ist für die Rekrutierung des Proteasoms verantwortlich, dem inhärenten Proteinabbausystem in menschlichen Zellen. Durch dieses Design wirkt das Molekül wie ein „Trojanisches Pferd“. Nach dem Eindringen in eine infizierte Zelle kann es sich an den viralen Ribonukleoproteinkomplex, den Kern der Virusreplikation und gleichzeitig den „Brecher“ der Zelle, heften, wodurch das Kernprotein des Virus als „Zerstörungsmarkierung“ markiert wird und dann die zelluläre Maschinerie angesteuert wird, diese Schlüsselteile für die Virusreplikation vollständig abzubauen, wodurch die Replikationsfähigkeit des Virus von der Quelle aus zerstört wird.
Die experimentellen Ergebnisse des Teams zeigen, dass die multiple PROTAC-Strategie eine hervorragende antivirale Leistung aufweist. Es kann nicht nur die Virusreplikation konzentrationsabhängig wirksam hemmen, sondern seine hemmende Wirkung kann auch mehr als 48 Stunden anhalten. Seine Persistenz und Wirksamkeit sind deutlich besser als bei Einzelziel-Kontrollmedikamenten. Besonders wichtig ist, dass diese Strategie durch den synchronen Abbau mehrerer viraler Proteine erfolgreich eine hohe genetische Resistenzbarriere aufbaut. Das bedeutet, dass das Virus, wenn es entkommen will, gleichzeitig über wirksame Escape-Mutationen an mehreren wichtigen Zielen verfügen muss. Dies stellt für das Virus ein unüberwindbares Hindernis in der natürlichen Evolution dar und verringert das Risiko einer Arzneimittelresistenz. Darüber hinaus zeigte diese Strategie eine Breitbandaktivität gegen mehrere Influenzastämme, was ihr Potenzial als Breitbandmedikament gegen Influenza unterstreicht.
Die Gutachter bemerkten, dass die Vielseitigkeit dieser Strategie auch einen neuen technischen Weg und Fantasieraum für den Umgang mit anderen schnell mutierenden Viren in der Zukunft bietet.