иҝ‘ж—ҘпјҢеӣҪ家иҚҜзӣ‘еұҖеҸҠе®ЎиҜ„дёӯеҝғе…ҲеҗҺеҸ‘еёғе·ІдёҠеёӮдёӯиҚҜжіЁе°„еүӮдёҠеёӮеҗҺиҜ„д»·зӣёе…ійҖҡзҹҘпјҢж Үеҝ—зқҖдёӯиҚҜжіЁе°„еүӮзҡ„дёҠеёӮеҗҺиҜ„д»·еҚіе°Ҷиҝӣе…Ҙе®һиҙЁжҖ§жҺЁиҝӣйҳ¶ж®өгҖӮ
дёӯиҚҜжіЁе°„еүӮдёҠеёӮеҗҺиҜ„д»·зңҹзҡ„иҰҒжқҘдәҶгҖӮ
дёӯиҚҜжіЁе°„еүӮжү“е“Қж·ҳжұ°иөӣ
дёӯиҚҜжіЁе°„еүӮзҡ„дёҠеёӮеҗҺиҜ„д»·е·ҘдҪңе·Іиҝӣе…Ҙе®һиҙЁжҖ§зҡ„вҖңж·ҳжұ°иөӣвҖқйҳ¶ж®өпјҢдёҙеәҠиҺ·зӣҠжҳҺзЎ®зҡ„е“Ғз§Қе°ҶиҺ·еҫ—ж”ҝзӯ–ж”ҜжҢҒгҖӮ
еӣҪ家иҚҜзӣ‘еұҖиҝ‘ж—ҘеңЁйҖҡзҹҘдёӯжҳҺзЎ®жҸҗеҮәпјҢвҖңдё»еҠЁиҜ„д»·дёҖжү№гҖҒиҙЈд»ӨиҜ„д»·дёҖжү№гҖҒдҫқжі•ж·ҳжұ°дёҖжү№вҖқзҡ„еҲҶзұ»зӣ‘з®Ўи·Ҝеҫ„пјҢдҪ“зҺ°еҮәжё…жҷ°зҡ„ж”ҝзӯ–еҜјеҗ‘гҖӮ
еңЁејәеҢ–зӣ‘з®Ўзҡ„еҗҢж—¶пјҢй…ҚеҘ—ж”ҜжҢҒж”ҝзӯ–д№ҹеҗҢжӯҘжҳҺзЎ®гҖӮ
дёҖж–№йқўпјҢиҚҜзӣ‘еұҖе°ҶдёәдёӯиҚҜжіЁе°„еүӮдёҠеёӮеҗҺз ”з©¶иҜ„д»·зӣёе…ізҡ„жіЁеҶҢз”іиҜ·и®ҫз«ӢеҚ•зӢ¬е®ЎиҜ„еәҸеҲ—пјҢжҳҫи‘—еҠ еҝ«е®Ўжү№йҖҹеәҰпјӣеҸҰдёҖж–№йқўпјҢеҜ№дёҙеәҠиҺ·зӣҠеӨ§дәҺйЈҺйҷ©зҡ„е“Ғз§ҚпјҢж”ҜжҢҒе…¶жіЁеҶҢж ҮеҮҶдјҳе…ҲиҪ¬еҢ–дёәеӣҪ家иҚҜе“Ғж ҮеҮҶгҖӮ
ж №жҚ®гҖҠеӣҪ家иҚҜе“ҒдёҚиүҜеҸҚеә”зӣ‘жөӢе№ҙеәҰжҠҘе‘ҠпјҲ2024е№ҙпјүгҖӢпјҢ2024е№ҙдёӯиҚҜдёҚиүҜеҸҚеә”/дәӢ件жҠҘе‘ҠдёӯпјҢжіЁе°„еүӮеҚ жҜ”дёә24.6%пјҢиҷҪиҝңдҪҺдәҺеҸЈжңҚеҲ¶еүӮзҡ„64.0%пјҢдҪҶиҖғиҷ‘еҲ°е…¶еёӮеңә规模пјҢе®үе…ЁжҖ§й—®йўҳд»ҚеҚҒеҲҶзӘҒеҮәгҖӮ
е…¬ејҖиө„ж–ҷжҳҫзӨәпјҢжҲ‘еӣҪдёӯиҚҜжіЁе°„еүӮд»…жңүдёҚеҲ°200дёӘе“Ғз§ҚгҖҒжү№ж–ҮдёҚи¶і1000дёӘпјҢзәҰдёәдёӯжҲҗиҚҜжҖ»жү№ж–Үж•°зҡ„1/60пјӣе…¶еёӮеңә规模зәҰ400дәҝе…ғпјҢдёҚеҲ°дёӯиҚҜж•ҙдҪ“еёӮеңәзҡ„1/10гҖӮ
然иҖҢпјҢе…¶дёҚиүҜеҸҚеә”еҸ‘з”ҹзҺҮеҚҙзәҰеҚ дёӯжҲҗиҚҜжҖ»дҪ“зҡ„1/4гҖӮиҝҷдёҖеҸҚе·®иҜҙжҳҺпјҢдёӯиҚҜжіЁе°„еүӮе·ІжҲҗдёәиҚҜе“Ғе®үе…Ёзӣ‘жөӢзҡ„йҮҚзӮ№йўҶеҹҹпјҢзі»з»ҹжҖ§ејҖеұ•дёҠеёӮеҗҺеҶҚиҜ„д»·е…·жңүй«ҳеәҰзҡ„зҙ§иҝ«жҖ§дёҺдёҙеәҠж„Ҹд№үгҖӮ
еҝ…иҰҒжҖ§иҜҙжҳҺжҳҜ第дёҖйҒ“е…іеҸЈ
еӣҪ家иҚҜзӣ‘еұҖзқҖжүӢдёӯиҚҜжіЁе°„еүӮдёҠеёӮеҗҺиҜ„д»·зҡ„зӣёе…іиҰҒжұӮж–Ү件еҲқзЁҝе·ІдәҺ2023е№ҙиө·иҚүе®ҢжҲҗпјҢеҗҺз»ӯе·Із»ҸиҝҮеӨҡж¬Ўи®Ёи®әгҖҒе®Ңе–„пјҢзӣҙиҮіж—ҘеүҚе…¬ејҖеҸ‘еёғгҖӮ
гҖҠдёӯиҚҜжіЁе°„еүӮдёҠеёӮеҗҺз ”з©¶е’ҢиҜ„д»·еҹәжң¬жҠҖжңҜиҰҒжұӮпјҲеҫҒжұӮж„Ҹи§ҒзЁҝпјүгҖӢпјҢжҳҺзЎ®жҸҗеҮәеқҡжҢҒжңҖдёҘи°Ёзҡ„ж ҮеҮҶпјҢдёӯиҚҜжіЁе°„еүӮзҡ„жҢҒжңүдәәеә”еҪ“еҹәдәҺиҚҜзӣ‘йғЁй—Ёж ёеҮҶжҲ–иҖ…з¬ҰеҗҲгҖҠиҚҜе“ҒдёҠеёӮеҗҺеҸҳжӣҙз®ЎзҗҶеҠһжі•гҖӢ第дәҢеҚҒдёүжқЎжңү关规е®ҡзҡ„еӣәе®ҡз”ҹдә§е·ҘиүәпјҢеҸӮз…§зҺ°иЎҢжҠҖжңҜиҰҒжұӮејҖеұ•дёӯиҚҜжіЁе°„еүӮдёҠеёӮеҗҺз ”з©¶е’ҢиҜ„д»·пјҢжҸҗеҚҮдә§е“ҒиҙЁйҮҸпјҢдҝқиҜҒдёӯиҚҜжіЁе°„еүӮзҡ„е®үе…ЁгҖҒжңүж•ҲгҖҒиҙЁйҮҸеҸҜжҺ§гҖӮ
еӣ жӯӨпјҢиҚҜдјҒеңЁеҹәдәҺдёҘи°Ёзҡ„ж ҮеҮҶжҺЁиҝӣжҹҗдёӘе“Ғз§ҚдёҠеёӮеҗҺиҜ„д»·е·ҘдҪңд№ӢеүҚпјҢдёӯиҚҜжіЁе°„еүӮеҝ…иҰҒжҖ§жҳҜйҰ–иҰҒи®әиҜҒзҡ„й—®йўҳгҖӮ
ж №жҚ®гҖҠдёӯиҚҜжіЁе°„еүӮдёҠеёӮеҗҺз ”з©¶е’ҢиҜ„д»·еҹәжң¬жҠҖжңҜиҰҒжұӮпјҲеҫҒжұӮж„Ҹи§ҒзЁҝпјүгҖӢ规е®ҡпјҢиҰҒйҰ–е…Ҳж»Ўи¶ідёүдёӘеҹәжң¬жқЎд»¶пјҡ
дёҖжҳҜжіЁе°„з»ҷиҚҜйҖ”еҫ„зҡ„еҝ…иҰҒжҖ§гҖӮдёӯиҚҜжіЁе°„еүӮеә”еҪ“жҳҜи§ЈеҶіеҸЈжңҚзӯүе…¶д»–йқһжіЁе°„з»ҷиҚҜйҖ”еҫ„дёҚиғҪжңүж•ҲеҸ‘жҢҘдҪңз”Ёж—¶зҡ„еүӮеһӢйҖүжӢ©пјҢе·ІжңүеҸЈжңҚз»ҷиҚҜйҖ”еҫ„иҚҜзү©иғҪеӨҹж»Ўи¶ідёҙеәҠжІ»з–—йңҖжұӮзҡ„пјҢдёҚе®ңйҮҮз”ЁжіЁе°„з»ҷиҚҜйҖ”еҫ„пјӣиӮҢиӮүжіЁе°„иғҪеӨҹж»Ўи¶ідёҙеәҠжІ»з–—йңҖжұӮзҡ„пјҢдёҚе®ңйҮҮз”Ёйқҷи„үжіЁе°„гҖӮ
дәҢжҳҜеҠҹиғҪдё»жІ»е’ҢдёҙеәҠе®ҡдҪҚзҡ„еҗҲзҗҶжҖ§гҖӮеҠҹиғҪдё»жІ»е’ҢдёҙеәҠе®ҡдҪҚжҳҺзЎ®пјҢз»ҷиҚҜж–№жЎҲе…·дҪ“жё…жҷ°пјҢеә”еҪ“з¬ҰеҗҲеҪ“еүҚ科еӯҰи®ӨиҜҶе’ҢдёҙеәҠиҜҠз–—йңҖжұӮеҸҠе®һи·өпјҢеә”еҪ“з”ЁдәҺжҖҘз—ҮгҖҒйҮҚз—ҮзӯүдёҚе®ңйҮҮз”ЁеҸЈжңҚзӯүйқһжіЁе°„з»ҷиҚҜзҡ„дёҙеәҠе®ҡдҪҚгҖӮ
дёүжҳҜйЈҺйҷ©иҺ·зӣҠиҜ„дј°гҖӮжңүи¶іеӨҹз ”з©¶ж•°жҚ®ж”ҜжҢҒеҜ№иҜҘе“Ғз§ҚејҖеұ•дёҙеәҠиҜ•йӘҢзҡ„йЈҺйҷ©иҺ·зӣҠиҜ„дј°пјҢдё”е·Іжңүж•°жҚ®жҸҗзӨәж— жҳҺжҳҫе®үе…ЁжҖ§жӢ…еҝ§гҖӮ
еҹәдәҺгҖҠдёӯиҚҜжіЁе°„еүӮдёҠеёӮеҗҺз ”з©¶е’ҢиҜ„д»·еҹәжң¬жҠҖжңҜиҰҒжұӮпјҲеҫҒжұӮж„Ҹи§ҒзЁҝпјүгҖӢзҡ„第дёҖйЎ№гҖҒд№ҹжҳҜжңҖйҮҚиҰҒзҡ„еүҚжҸҗжқЎд»¶е°ұжҳҜпјҢе·ІжңүеҸЈжңҚеүӮзҡ„дёӯиҚҜжіЁе°„еүӮе“Ғз§Қе°ҶйҰ–еҪ“е…¶еҶІйңҖиҰҒе……еҲҶиҜҙжҳҺе…¶еҝ…иҰҒжҖ§гҖӮ
жҚ®з¬”иҖ…з»ҹи®ЎпјҢдёӯиҚҜжіЁе°„еүӮе“Ғз§Қжңү134дёӘпјҲеү”йҷӨеүӮеһӢеҗҺ119дёӘе“Ғз§ҚпјүпјҢе…¶дёӯжңү63дёӘе“Ғз§ҚпјҲеү”йҷӨеүӮеһӢеҗҺ54дёӘе“Ғз§ҚпјүйҷӨдәҶжіЁе°„еүӮд»ҘеӨ–пјҢе·ІжңүдёҖдёӘжҲ–еӨҡдёӘеҗҢеҗҚеҸЈжңҚеүӮеһӢпјҲиҜҰи§Ғж–Үжң«иЎЁж јпјүгҖӮ
иҝҷзұ»е“Ғз§ҚеҰӮжһңдёҚиғҪе……еҲҶиҜҒжҳҺдёӯиҚҜжіЁе°„еүӮеӯҳеңЁзҡ„еҝ…иҰҒжҖ§пјҢе°Ҷйқўдёҙиў«ж·ҳжұ°еҮәеұҖпјҢзӣҙжҺҘеӨұеҺ»дёҠеёӮеҗҺиҜ„д»·зҡ„иө„ж јгҖӮ
йғЁеҲҶдјҒдёҡе·ІжңүдёӯиҚҜжіЁе°„еүӮдёҠеёӮеҗҺиҜ„д»·е·ҘдҪңеҹәзЎҖ
дёӯиҚҜжіЁе°„еүӮдёҠеёӮеҗҺиҜ„д»·е·ҘдҪңзҡ„еҺҶеҸІеҸҜиҝҪжәҜиҮі2009е№ҙгҖӮ
гҖҠе…ідәҺејҖеұ•дёӯиҚҜжіЁе°„еүӮе®үе…ЁжҖ§еҶҚиҜ„д»·е·ҘдҪңзҡ„йҖҡзҹҘгҖӢеҸ‘еёғпјҢеңЁжӯӨж”ҝзӯ–еј•еҜјдёӢпјҢйғЁеҲҶдјҒдёҡзҺҮе…ҲеҗҜеҠЁзӣёе…іе®үе…ЁжҖ§еҶҚиҜ„д»·з ”з©¶гҖӮ
е°Ҫз®Ўе…¶дёӯйғЁеҲҶз ”з©¶еңЁеҪ“ж—¶еёҰжңүдёҖе®ҡзҡ„еёӮеңәжҺЁе№ҝж„ҸеӣҫпјҢдҪҶе®ўи§ӮдёҠдёәиҝҷдәӣдјҒдёҡз§ҜзҙҜдәҶжүҺе®һзҡ„з ”з©¶еҹәзЎҖгҖӮеңЁеҪ“еүҚж–°дёҖиҪ®иҜ„д»·е·ҘдҪңе…ЁйқўжҺЁиҝӣзҡ„иғҢжҷҜдёӢпјҢиҝҷдәӣж—©жңҹеёғеұҖзҡ„дјҒдёҡжңүжңӣеҮӯеҖҹе…ҲеҸ‘дјҳеҠҝпјҢеңЁж”ҝзӯ–дёҺе®һи·өеұӮйқўжҠўеҚ е…ҲжңәгҖӮ

жіЁпјҡж №жҚ®е…¬ејҖзҪ‘з»ңиө„ж–ҷе’ҢдёҠеёӮе…¬еҸёе№ҙжҠҘж•ҙзҗҶпјҢдёҚе®Ңе…Ёз»ҹи®ЎпјҢдҫӣеҸӮиҖғгҖӮ
дёӯиҚҜжіЁе°„еүӮдёҠеёӮеҗҺиҜ„д»·пјҡеҫӘиҜҒиҜҒжҚ®еҶіе®ҡз”ҹжӯ»
дёӯиҚҜжіЁе°„еүӮдёҠеёӮеҗҺиҜ„д»·з»ҷдәҲдјҒдёҡ3е№ҙз ”з©¶жңҹйҷҗпјҢж•ҙдёӘеҶҚиҜ„д»·е·ҘдҪңзҡ„жңҖеҗҺеӨ§йҷҗдёҚи¶…иҝҮ2030е№ҙгҖӮдјҒдёҡйңҖеңЁжңҹйҷҗеҶ…е®ҢжҲҗиҚҜеӯҰз ”з©¶гҖҒе·ҘиүәжҺ§еҲ¶гҖҒиҙЁйҮҸж ҮеҮҶжҸҗеҚҮзӯүе·ҘдҪңпјҢ并жҸҗдәӨдёҙеәҠе®үе…ЁжҖ§гҖҒжңүж•ҲжҖ§ж•°жҚ®гҖӮ
йҫҷеӨҙдјҒдёҡдёҺдёӯе°ҸдјҒдёҡеҸҜиғҪеҮәзҺ°еҲҶеҢ–гҖӮйҫҷеӨҙдјҒдёҡе…·еӨҮз ”еҸ‘гҖҒдёҙеәҠе’ҢиҙЁйҮҸдҪ“зі»пјҢеҸҜйҖҡиҝҮеҶҚиҜ„д»·жҸҗеҚҮеёӮеңәд»ҪйўқгҖӮдҫӢеҰӮпјҢдёҠжө·еҮҜе®қзӯүдјҒдёҡиҷҪйқўдёҙж ёеҝғдә§е“Ғй”ҖйҮҸдёӢж»‘пјҢдҪҶд»ҚеңЁз§ҜжһҒжҠ•е…Ҙз ”з©¶гҖӮдёӯе°ҸдјҒдёҡеӣ жҲҗжң¬й«ҳгҖҒжҠҖжңҜиғҪеҠӣдёҚи¶іпјҢеҸҜиғҪйҖүжӢ©дё»еҠЁйҖҖеҮәжҲ–иў«ж·ҳжұ°гҖӮ
жҚ®дё“家预жөӢпјҢжӯӨж¬Ўж”ҝзӯ–е®һж–ҪеҗҺпјҢдёҖеҚҠд»ҘдёҠзҡ„дёӯиҚҜжіЁе°„еүӮеҸҜиғҪиў«ж·ҳжұ°гҖӮ
йҷ„пјҡжіЁе°„еүӮеҜ№еә”еҸЈжңҚеүӮдә§е“ҒиҜҰеҚ•
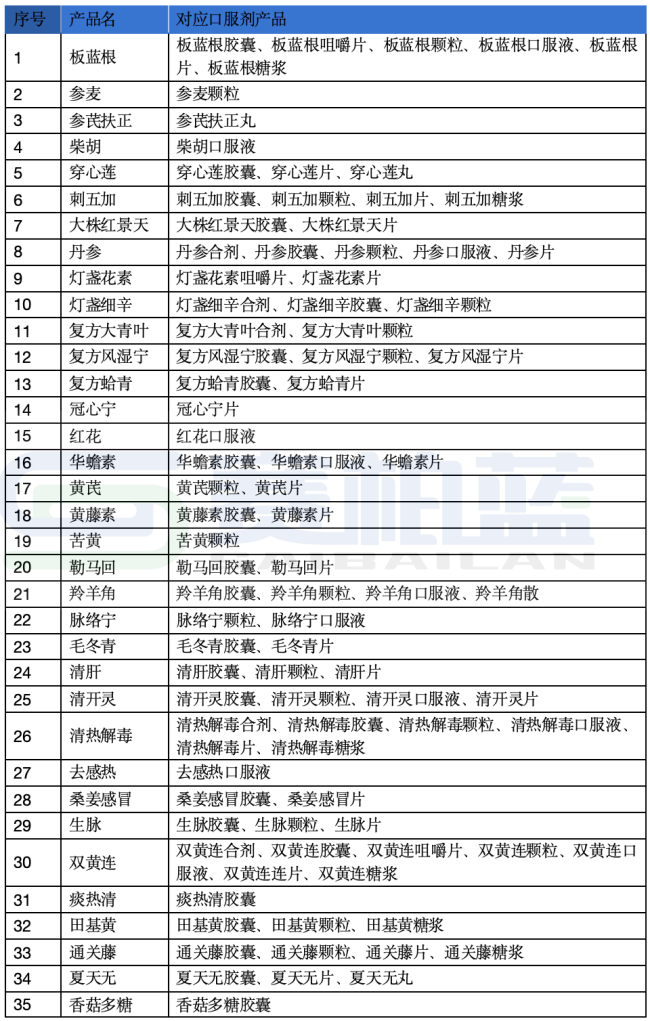
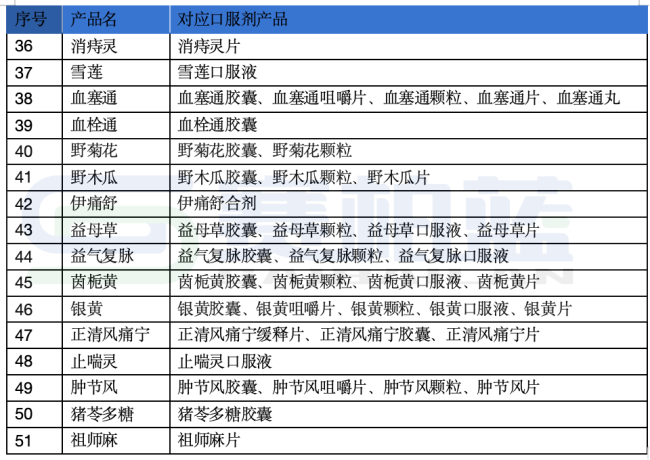
жіЁпјҡж №жҚ®е…¬ејҖиө„ж–ҷжүӢеҠЁж•ҙзҗҶпјҢдҫӣеҸӮиҖғгҖӮ